
HLB는 최근 미국 FDA에 간암 치료제 '리보세라닙'의 허가 재신청을 준비하고 있습니다. 이 과정에서 여러 가지 변화와 도전이 있었습니다.
HLB의 FDA 승인 현황
- 리보세라닙 허가 재신청: HLB는 리보세라닙의 FDA 허가 재신청을 9월 말이나 10월까지 목표로 하고 있으며, 연말까지는 확실히 제출할 계획입니다.
- FDA와의 미팅: HLB는 최근 FDA와 리보세라닙 허가 심사 재개를 위한 미팅을 완료했습니다. 이 미팅에는 HLB의 미국 자회사인 엘레바 테라퓨틱스도 참여했습니다.
HLB의 주가와 시장 반응
- 주가 하락: 리보세라닙의 FDA 허가가 지연되면서 HLB의 주가는 하락세를 보였습니다. 그러나 바이오 업계에서는 이 상황이 큰 악영향을 미치지 않을 것이라는 전망도 있습니다.
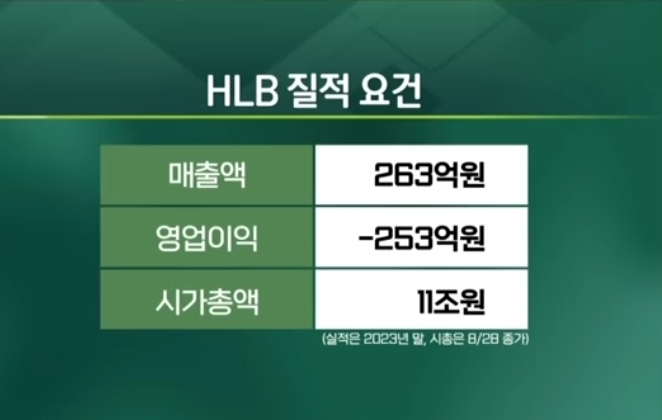
- 기업 가치: HLB는 국내 최초의 FDA 간암 치료제 허가를 목표로 하여 기업 가치를 크게 키워왔습니다. 그러나 허가 무산 소식이 전해지기 전까지의 기업 가치는 약 12조5000억원에 달했습니다.
HLB의 향후 계획
- 신약 개발 지속: HLB는 리보세라닙 외에도 다양한 신약 개발을 지속적으로 추진하고 있으며, FDA와의 협력을 통해 신약 허가를 위한 노력을 강화할 계획입니다.
- 글로벌 시장 진출: HLB는 글로벌 시장에서의 경쟁력을 높이기 위해 다양한 전략을 모색하고 있습니다.
HLB는 리보세라닙의 FDA 허가 재신청을 통해 간암 치료제 시장에서의 입지를 강화하고자 합니다. 이 과정에서의 도전과 기회는 HLB의 미래 성장 가능성을 더욱 높일 것으로 기대됩니다. HLB의 지속적인 노력과 혁신이 앞으로의 성과로 이어지길 바랍니다.
댓글